Présentation
RÉSUMÉ
Il existe deux types de procédés d’obtention de l’hypochlorite de sodium développés industriellement : le procédé chimique et le procédé électrochimique. Les procédés chimiques, présentés ici, consistent en une chloration de la soude par du chlore gazeux. Le procédé standard permet l’obtention d’eau de Javel à 13 % de chlore actif. Le procédé « Haut Titre », breveté par Arkema, fait réagir le chlore avec une solution de soude à 50 % et conduit à une eau de Javel à 24-26 % de chlore actif.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleABSTRACT
There are two types of processes for producing sodium hypochlorite that are developed industrially: chemical and electrochemical. The chemical processes, presented here, consist of soda chlorination using chlorine gas. The standard process produces 13% active chlorine bleach. The “Haut Titre” process, patented by Arkema, causes chlorine to react with a 50% soda solution to produce 24–26% active chlorine bleach.
Auteur(s)
-
Jean-Christophe MILLET : Responsable procédés. Division chlorochimie - Arkema
INTRODUCTION
Il existe deux types de procédés d’obtention de l’hypochlorite de sodium développés industriellement :
-
le procédé chimique qui fait l’objet principal de ce texte ;
-
le procédé électrochimique dans lequel une solution de chlorure de sodium (saumure ou eau de mer) alimente des électrolyseurs avec ou sans séparateur, avec génération de chlore à l’anode et production de soude à la cathode. Il y a obtention d’hypochlorite in situ dans le cas d’électrolyseurs dépourvus de séparateur ; dans le cas contraire, les deux réactifs sont mélangés dans un réacteur spécifique. Ce procédé est caractérisé par l’obtention de solutions diluées à moins de 10 g/l de chlore actif.
VERSIONS
- Version archivée 1 de juin 1993 par Dominique RAVIER
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(359 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Définitions
Les « extraits et eaux de Javel » sont des solutions aqueuses d’hypochlorite de sodium NaClO, généralement obtenues en faisant réagir le chlore sur la soude caustique. Ces solutions contiennent également du chlorure de sodium NaCl formé lors de la réaction :
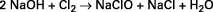
avec ΔH = – 103,2 kJ/mole Cl2
Dans le passé, la concentration des eaux et extraits de Javel était exprimée dans les pays francophones en degré chlorométrique et, ailleurs, par la quantité de chlore actif. Le nombre de degrés chlorométriques était le nombre de litres de chlore gazeux que pouvait dégager un litre de solution sous l’action d’un acide à la température de 0 ˚C et à la pression atmosphérique :
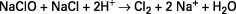
Il était égal au nombre de litres de chlore gazeux ayant servi à fabriquer un litre de solution. Un degré chlorométrique (˚chl) correspondait à 3,17 g Cl2/L soit 0,31 % de chlore actif pour une solution de densité moyenne égale à 1,004. Désormais, on utilise, comme les autres pays européens, le pourcentage massique de chlore actif.
La formule à utiliser pour transformer les ˚chl en % chlore actif est la suivante :
avec :
- d :
- densité de l’extrait de Javel considéré.
Le tableau 1 donne quelques correspondances.
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(359 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Définitions
BIBLIOGRAPHIE
-
(1) - INRS - Eaux et extraits de Javel - . Fiche toxicologique, no FT157, INRS (édition 2006).
-
(2) - ULLMANN’s Encyclopedia of Industrial Chemistry - * - Vol. A6, p. 484 à 496, VCH (Verlag Chemie) (1986).
-
(3) - SECEM/AEU - Nouveaux extraits de Javel commerciaux et leurs procédés de fabrication - . Brevet américain US Pat 1352198 déposé le 20 déc. 1962.
-
(4) - PCUK - Procédé continu pour la préparation de solutions de NaClO très concentrées - . Brevet français no 2532291 déposé le 24 août 1982. Brevet américain US Pat 4780303 déposé le 30 mars 1987.
-
(5) - ELF ATOCHEM - Procédé de préparation de solutions concentrées d’hypochlorite de métal alcalin - . Brevet européen no 527083 du 6 août 1991.
-
...
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(359 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Un Parcours Pratique
Opérationnel et didactique, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive