Présentation
Auteur(s)
-
José Pedro SANCHO MARTINEZ : Professeur de Métallurgie. École des Mines d’Oviedo (Espagne)
-
Francisco BLANCO ALVAREZ : Professeur Assistant de Métallurgie. École des Mines d’Oviedo (Espagne)
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le mercure est un métal connu depuis l’Antiquité (civilisations préromaines). On sait que le mercure était le dernier des sept métaux connus par les peuples avant Jésus-Christ. Sa noblesse permit à l’homme de le trouver à l’état naturel ou de le réduire avec facilité. Aussi bien le caractère liquide du métal, à température ambiante, que son aspect brillant et sa grande masse volumique firent que ce métal intéressa les civilisations antiques. Par ailleurs, le cinabre, principal minerai du mercure, était utilisé plusieurs siècles avant Jésus-Christ comme produit colorant (vermillon) dans les teintures et peintures.
La connaissance métallurgique du mercure comme métal, avec la faculté d’amalgamer l’or et l’argent, ne laisse aucun doute en ce qui concerne les Romains qui, lors de leur conquête de l’Hispanie, extrayèrent plusieurs millions de kilos d’or. Ils appliquaient la technique de l’amalgamation aux métaux fins difficiles à récupérer par concentration gravimétrique. Ajoutant à ceux‐ci du mercure, les amalgames étaient ensuite nettoyés avec l’eau et soumis au feu. L’or (et éventuellement l’argent) restait dans le fond du creuset distillateur.
Le mercure était autrefois utilisé dans la fabrication de miroirs : on l’amalgamait à de l’étain. Paracelso, médecin naturaliste suisse (1493-1541), l’introduisit dans ses préparations médicales (traitement de la syphilis). En 1643, Torricelli utilisa le mercure dans son baromètre et, en 1720, Fahrenheit l’utilisa dans son thermomètre. En 1799, Howard découvrit le fulminate de mercure, produit essentiel dans la fabrication des détonateurs, dont l’usage se maintint jusqu’à récemment.
De nos jours, le mercure a d’autres applications comme par exemple : les produits chimiques, les pesticides, les antiseptiques, l’électrolyse de chlorures (chlore-soude), la production de courant redressé, l’appareillage électrique, les piles. Cependant, son pouvoir contaminant fait que l’on a tendance à le remplacer dans un bon nombre de ses applications classiques. Ainsi, le fulminate de mercure a été écarté des détonateurs, les ignitrons qui utilisaient de grosses quantités de mercure ont fait place aux redresseurs secs. Dans les pesticides, il a été remplacé par d’autres éléments non contaminants des eaux et des aliments. L’inhalation continue de vapeurs de mercure produit l’hydrargyrisme : maladie nerveuse dégénérative.
Aujourd’hui, le mercure est récupéré dans presque tous les grillages de minerais complexes, particulièrement ceux du zinc (concentré de blende ou sphalérite). Sa récupération est obligatoire pour éviter tout problème de contamination et il existe des zones productrices comme Avilés (Asturies, en Espagne) qui produisent des centaines de flacons à l’année (1 flacon » 34,5 kg).
Dans tous les cas, les propriétés singulières de ce métal, sa noblesse et son état, liquide à température ambiante, comme les propriétés de certains de ses composés, nous permettent d’exprimer un certain optimisme face à l’immense campagne anti-mercure qui a fait diminuer les prix de manière extraordinaire, fermer des mines, mettant en vente des stocks stratégiques et arrêtant le fonctionnement d’installations métallurgiques.
Sauf précision contraire, les pourcentages cités dans cet article sont des pourcentages massiques.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Élaboration et recyclage des métaux
(120 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Généralités
1.1 Propriétés du métal
Les caractéristiques sont données dans le tableau 1.
Le mercure cristallise dans le système rhomboédrique. Solide, il est blanchâtre et ductile.
Le mercure est 47 fois moins conducteur que le cuivre. Sa pression de vapeur p (en kPa) en fonction de la température T (en K) est donnée par :
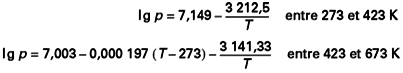
La tension superficielle du mercure est élevée (0,445 N/m).
HAUT DE PAGE
Les caractéristiques sont données dans le tableau 1.
À l’air sec, le mercure ne s’oxyde pas. À l’air humide, il s’oxyde en Hg2O ou HgO. Le mercure peut former HgO à 300 oC environ, mais à 476 oC celui‐ci se dissocie très facilement, donnant Hg à l’état de vapeur.
Le mercure n’est pas attaqué par HCl ni par H2SO4 dilué à basse température. Avec ce dernier, concentré et à haute température, il forme des sulfates. HNO3 attaque Hg même dilué, produisant du nitrate HgNO3 . L’eau régale (3 volumes HCl + 1 volume HNO3) le transforme en HgCl2 (mercure corrosif).
Les alliages du mercure avec d’autres métaux se nomment amalgames et sont des dissolutions par le mercure du métal correspondant. Sa facilité de s’amalgamer avec l’or et l’argent est la base de certains procédés primaires de récupération. Le mercure s’amalgame avec de nombreux autres métaux comme Al, Zn, Pb et Sn. Les amalgames se décomposent à la chaleur, distillant le mercure à l’état de vapeur. Sb, Cu et Pt s’allient difficilement et Fe, Ni et Co ne s’allient pas...
Cet article fait partie de l’offre
Élaboration et recyclage des métaux
(120 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Généralités
Cet article fait partie de l’offre
Élaboration et recyclage des métaux
(120 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










