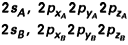Présentation
Auteur(s)
-
Richard PORTIER : Ingénieur de l’École Nationale Supérieure de Chimie de Paris - Professeur à l’Université Paris VI
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Le calcul des systèmes polyélectroniques est rendu délicat par le fait qu’il n’existe pas de solutions analytiques exactes. Il convient donc d’utiliser des méthodes de résolutions approximatives et l’article Systèmes polyélectroniques modèles a permis de les présenter. Ainsi, l’approximation monoélectronique, pour laquelle chaque électron est décrit par une fonction qui ne dépend que de ses coordonnées, conduit à des équations dites de champ moyen où les répulsions interélectrons ne sont pas traitées de manière instantanée mais sont en fait moyennées. De plus, dans le cadre de cette approximation, les fonctions monoélectroniques de la molécule, les orbitales moléculaires, peuvent être développées sur une base formée par un nombre fini d’orbitales atomiques des atomes qui composent la molécule. Cette méthode a été testée sur l’ion moléculaire
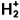 pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
pour lequel nous connaissons des solutions exactes. C’est cette méthode que nous allons étendre au cas des molécules plus complexes. Les énergies des orbitales atomiques, c’est-à-dire des niveaux monoélectroniques des atomes, sont reportées sur le tableau 1.
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique Chimie
(205 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
5. Molécules diatomiques hétéronucléaires
Les molécules diatomiques hétéronucléaires conduisent à une répartition non symétrique des électrons, contrairement au cas des molécules homonucléaires.
Nous pouvons, avec l’aide de la théorie des groupes, prévoir raisonnablement les caractéristiques de ces molécules.
5.1 Cas général
Les atomes n’étant plus de même espèce, nous observons un abaissement de symétrie par rapport au cas des molécules diatomiques homonucléaires. Nous allons fixer les référentiels.
Le référentiel général et ceux attachés à chaque atome, par rapport auxquels nous repérons les orbitales atomiques, sont représentés figure 22 (ces trièdres n’ont pas besoin d’être directs).
Les éléments de symétrie sont :
-
l’identité ;
-
une infinité d’axes de rotation quelconques selon z ;
-
une infinité de miroirs passant par z .
Le groupe ponctuel infini est C∞v et sa table de caractères est donnée par le tableau 10.
Dans le cadre de la méthode LCAO‐MO, les orbitales atomiques à considérer sont (jusqu’au fluor) :
-
orbitales de cœur : 1sA , 1sB ;
-
orbitales de valence :
![]()
Les propriétés de transformation des orbitales atomiques sont aisément déterminées de la même manière que pour les molécules homonucléaires diatomiques. Elles sont bases de représentations irréductibles de C∞v (notons que chaque atome étant invariant par action des opérations de symétrie, une orbitale atomique seule peut être base d’une représentation irréductible) :
Le mélange de 2s et de 2pz pour chaque atome, permis par la symétrie, conduit à deux orbitales hybrides (figure 23). Cela est aussi valable pour les molécules diatomiques homonucléaires mais n’a...
Cet article fait partie de l’offre
Physique Chimie
(205 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Molécules diatomiques hétéronucléaires
Cet article fait partie de l’offre
Physique Chimie
(205 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive