Présentation
RÉSUMÉ
Les informations concernant la thermodynamique des équilibres entre phases sous pression sont essentielles en génie énergétique, car de nombreux procédés industriels fonctionnent sous pression. Beaucoup de modèles ont été proposés pour la représentation fidèle des propriétés thermodynamiques. Aujourd’hui, de nouveaux modèles thermodynamiques, encore plus précis, sont développés. Ces modèles serviront à réduire le nombre de points expérimentaux à déterminer. Ils permettront de dimensionner des unités et d'améliorer la compréhension des phénomènes physiques mis en jeux.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Christophe COQUELET : Maître-assistant à l'École des mines de Paris - Docteur de l'École des mines de Paris - Professeur agrégé de l'université ; ancien élève de l'ENS Cachan - Ingénieur ENSIACET
-
Dominique RICHON : Directeur de recherche à l'École des mines de Paris - Responsable du laboratoire CEP/TEP
INTRODUCTION
Les informations concernant la thermodynamique des équilibres entre phases sous pression sont essentielles en génie énergétique. En effet, de nombreux procédés industriels fonctionnent sous pression : traitement du gaz naturel, extraction par fluides supercritiques, procédés géologiques (séquestration), réfrigération, etc. À ce jour, beaucoup de modèles ont été proposés (corps purs et mélanges) pour la représentation fidèle des propriétés thermodynamiques, prenant en compte les comportements des différents systèmes couramment rencontrés dans le domaine industriel. Toutefois, grâce aux informations précises fournies par les expériences effectuées en laboratoire, de nouveaux modèles thermodynamiques, encore plus précis, pourront être développés. Ces modèles serviront, d'une part, à réduire le nombre de points expérimentaux à déterminer (modèles prédictifs) et, d'autre part, ils permettront d'effectuer le dimensionnement des unités et d'améliorer la compréhension des phénomènes physiques mis en jeux. L'évaluation énergétique des procédés nécessite également des modèles thermodynamiques très précis. C'est à partir des modèles thermodynamiques que l'on peut évaluer et effectuer les bilans énergétiques, entropiques et exergétiques. Ainsi, on ne peut se contenter, lors du calcul d'un coefficient de performance d'un cycle de réfrigération (par exemple), d'utiliser des modèles thermodynamiques dont l'incertitude sur le calcul de la densité est trop importante. De même que l'utilisation du gaz parfait a une utilisation très limitée.
Pour plus d'informations, le lecteur pourra consulter les références Propriétés thermodynamiques- Détermination pour les fluides purs[27] Propriétés thermodynamiques- Détermination pour les fluides purs[28] Propriétés thermodynamiques- Détermination pour les fluides purs[29] Propriétés thermodynamiques- Détermination pour les fluides purs[30] Propriétés thermodynamiques- Détermination pour les fluides purs[31] Propriétés thermodynamiques- Détermination pour les fluides purs[32] Propriétés thermodynamiques- Détermination pour les fluides purs[33] Propriétés thermodynamiques- Détermination pour les fluides purs[34] parues dans les Techniques de l'Ingénieur (cf. Propriétés thermodynamiques- Détermination pour les fluides purs[Doc BE 8 030]).
VERSIONS
- Version courante de sept. 2020 par Salaheddine CHABAB, Patrice PARICAUD, Christophe COQUELET
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Physique énergétique
(74 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
6. Calcul de la tension de vapeur
L'équilibre thermodynamique est défini par dg (T, P) = 0, où g désigne l'enthalpie libre molaire de Gibbs. Pour une phase liquide et une phase vapeur, la relation d'équilibre est :
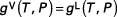
avec
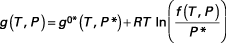
f désigne la fugacité du composé avec l'indice 0 désignant le corps pur, l'indice * désignant le gaz parfait. De là, à l'équilibre :
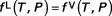
ou :
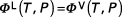
car
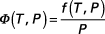
Φ désignant le coefficient de fugacité.
La fugacité traduit l'activité d'un corps pur hors conditions du gaz parfait. La fugacité d'un gaz parfait est sa pression.
Le calcul du coefficient de fugacité est établi à partir des relations de la thermodynamique. Pour un gaz parfait, nous pouvons écrire, pour une température constante :
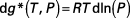 ( 43 )
( 43 )
Pour un fluide réel, l'enthalpie libre de Gibbs s'écrit en fonction de la fugacité :
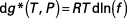 ( 44 )
( 44 )
De plus, quel que soit le fluide, nous avons dg (T, P) = vdP.
Ainsi,...
Cet article fait partie de l’offre
Physique énergétique
(74 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Calcul de la tension de vapeur
BIBLIOGRAPHIE
-
(1) - VAN DER WAALS (J.D.) - Over de continuiteit van den Gas- en Vloestoftoestand. (Über die Kontinuittät des Gas- und Flüssigkeitszustands). - 1873, Dissertation, Universität Leiden, Niederlande, deutsche Übersetzung, Leipzig (1899).
-
(2) - REDLICH (O.), KWONG (J.N.S.) - On the thermodynamics of solutions. V. An equation of state. Fugacities of gaseous solutions. - Chem. Rev., 44, p. 233-244, ACS (1949).
-
(3) - SOAVE (G.) - Equilibrium constants for modified Redlich-Kwong equation of state. - Chem. Eng. Sci., 4, p. 1197-1203, ACS (1972).
-
(4) - PENG (D.Y.), ROBINSON (D.B.) - A new two parameter equations of state. - Ind. Eng. Chem. Fundam., 15, p. 59-64, ACS (1976).
-
(5) - JI (W.R.), LEMPE (D.A.) - A systematic study of cubic three-parameter equations of state for deriving a structurally optimised PVT relation. - Fluid Phase Equilib., 147, p. 85-103, Elsevier (1998).
-
...
(liste non exhausive)
École des mines de Paris, Centre énergétique et Procédés, Laboratoire « Thermodynamique et équilibres entre phases », CNRS FRE 2861.
École nationale supérieure des techniques avancées (ENSTA), unité chimie et procédés (UCP).
École nationale supérieure de chimie physique de Bordeaux (ENSCPB), laboratoire TREFLE, UMR CNRS 8500.
École nationale supérieure des industries chimiques (ENSIC) (Nancy).
Université Claude-Bernard, Lyon 1, UFR Chimie et Biochimie, Laboratoire de chimie analytique.
Université de Pau et des Pays de l'Adour, laboratoire des fluides complexes, CNRS - UMR 5150 - CURS.
Université Paris XIII, laboratoire d'ingénierie des matériaux et des hautes pressions (LIMHP).
Université de la Méditerranée, département de chimie.
HAUT DE PAGE
COQUELET (C.) - Étude des fluides frigorigènes, mesures et modélisation. - Thèse École des mines de Paris, 180 p. (2003).
CHAPOY (A.) - Étude des Équilibres des systèmes eau-hydrocarbures-gaz acides dans le cadre de la production de gaz. - Thèse École des mines de Paris, 250 p. (2004).
RIVOLLET (F.) - Étude des propriétés volumétriques (PVT) d'hydrocarbures légers (C1-C4), du dioxyde de carbone...
Cet article fait partie de l’offre
Physique énergétique
(74 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive










