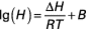Présentation
RÉSUMÉ
L’augmentation du gaz carbonique dans l’atmosphère est due en grande partie à l’activité humaine. En effet, cette teneur en gaz a subi une très forte croissance ces dernières années. Pour cette raison, la volonté de réduction des polluants atmosphériques est plus que jamais présente. Cette problématique permanente, abordée dans un contexte général, fait l’objet de cet article. Tout d’abord, la structure et les caractéristiques de la molécule sont rappelées. Puis différentes questions sont abordées, qu’elles traitent des sources d’émission, des impacts, de la métrologie, de la législation ou encore des solutions techniques existantes.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Pierre LE CLOIREC : Professeur, directeur scientifique - École de chimie de Rennes (ENSCR)
INTRODUCTION
Effet de serre, réchauffement de la planète, fonte de la banquise ou de tel glacier… toutes ces expressions sont maintenant entrées dans le langage du grand public du fait de propos plus ou moins alarmistes transmis par les médias. Les principales molécules à effet de serre sont répertoriées et définies. On trouve, avec leur valeur de contribution : la vapeur d'eau pour 55 %, le dioxyde de carbone (CO2) pour 39 %, le méthane (CH4) 2 %, l'ozone (O3) 2 %, le protoxyde d'azote (N2O) 2 % ainsi que, dans une moindre part, les halocarbones (chlorofluorocarbones (CFC), fréon, perfluorométhanes) et l'hexafluorure de soufre (SF6) [1]. Certains auteurs ne prennent pas en compte la vapeur d'eau et dans ce cas, bien sûr, les valeurs de répartition sont différentes. Dans ce présent dossier, nous nous intéresserons exclusivement au gaz carbonique dont l'augmentation dans l'atmosphère est due en grande partie à l'activité humaine. La figure 1, proposée par le Groupe d'experts intergouvernemental sur l'évolution du climat (GIEC), donne une évolution cyclique sur une très longue durée, et une forte croissance ces dernières années, de la teneur en gaz carbonique dans l'atmosphère. En 2005, la teneur moyenne en CO2 atmosphérique était de 379,1 ppm soit une augmentation de 2,9 % par rapport à 1993. Les conférences internationales de Rio et de Kyoto marquent une volonté de réduction des polluants atmosphériques. En 1997, le protocole de Kyoto impose aux 38 pays signataires de réduire de 5,2 % leurs émissions de gaz à effet de serre d'ici la période 2008-2012. Dans ce contexte, l'Union européenne a mis en place une directive, adoptée le 13 octobre 2003, prévoyant des quotas de rejets et des pénalités en cas de dépassement des engagements. Dans une approche écologique et/ou réglementaire, il est nécessaire de réduire les émissions de gaz à effet de serre et en particulier les rejets de dioxyde de carbone [2] [3]. C'est dans ce contexte général que sera abordée, dans ce dossier, la problématique du CO2.
VERSIONS
- Version archivée 2 de janv. 2017 par Pierre LE CLOIREC
- Version courante de déc. 2022 par Pierre LE CLOIREC
DOI (Digital Object Identifier)
CET ARTICLE SE TROUVE ÉGALEMENT DANS :
Accueil > Ressources documentaires > Archives > [Archives] Environnement > CO2 (dioxyde de carbone) > Structure et caractéristiques de la molécule
Accueil > Ressources documentaires > Archives > [Archives] Opérations unitaires - Génie de la réaction chimique > CO2 (dioxyde de carbone) > Structure et caractéristiques de la molécule
Cet article fait partie de l’offre
Chimie verte
(167 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Structure et caractéristiques de la molécule
Le dioxyde de carbone a été découvert, en 1638, par le médecin belge Jan Baptist Van Helmont. Vers 1750, il est étudié par Joseph Black, chimiste et physicien écossais. Joseph Priestley, pasteur anglais, isole le gaz carbonique en 1766 et c'est en 1776 que le chimiste français Antoine Laurent de Lavoisier met en évidence la production du CO2 lors de la combustion du carbone en présence d'oxygène.
Le tableau 1 regroupe quelques caractéristiques physico-chimiques du dioxyde de carbone.
À partir de sa structure moléculaire certaines propriétés macroscopiques peuvent être énoncées :
-
le CO2 représente le degré ultime d'oxydation du carbone. C'est une molécule assez stable et relativement inerte chimiquement ;
-
c'est un gaz acide légèrement soluble dans l'eau. La variation de la constante de Henry H (atm) avec la température T est donnée par une équation classique [5] :
![]()
avec :
- ΔH :
- = 8,65 J · mol–1
- B :
- = 6,73.
-
il peut être corrosif en présence de vapeur d'eau ;
-
en fonction du pH des solutions aqueuses, le dioxyde de carbone, après dissolution, forme des carbonates et bicarbonates plus ou moins solubles dans l'eau. Les équilibres calcocarboniques ont été largement étudiés en particulier pour les eaux de surface et les eaux destinées à l'alimentation humaine [6] [7]. Les équations d'équilibre peuvent être écrites de manière...
Cet article fait partie de l’offre
Chimie verte
(167 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Structure et caractéristiques de la molécule
En 2002, les États-Unis émettent près d'un quart des rejets de CO2 totaux. À cette même date, la part des émissions de la Chine et celle de l'Union européenne sont proches (tableau 1) ; certaines études prévoient que la Chine sera le premier pays émetteur de CO2 d'ici 2009. Le taux de participation de la France est relativement faible : les rejets proviennent majoritairement du transport routier, des habitations et bâtiments du tertiaire, des industries (tableau 2).
Pour une distance égale, le transport du CO2 par navire est plus avantageux économiquement (tableau 3). Le stockage du CO2 peut présenter de fortes disparités (tableau 4).
HAUT DE PAGERéférences
Centre interprofessionnel technique d'études de la pollution atmosphérique (CITEPA) - Inventaire des émissions de polluants atmosphériques en France. - CITEPA/CORALIE/Format SECTEN, (mise à jour février 2004) et site http://www.citepa.org.
Groupe d'experts intergouvernemental sur l'évolution du climat (GIEC) - Rapport spécial du GIEC – Piégeage et stockage du dioxyde de carbone. - Conférence des parties à...
Cet article fait partie de l’offre
Chimie verte
(167 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive