Présentation
RÉSUMÉ
La valeur de la constante d'acidité dans l'eau d'une espèce est une donnée thermodynamique d'un grand intérêt dans de nombreux domaines scientifiques. L'article décrit une méthode générale de détermination par simulation à l'aide d'un procédé de moindres carrés. Elle permet de surmonter certaines difficultés rencontrées telles qu'une faible solubilité du soluté ou un chevauchement de plusieurs acidités. Son application à la potentiométrie et à la spectrophotométrie UV-visible est détaillée. D'autres méthodes sont décrites aussi, mais plus brièvement. La détermination des pKa de composés très acides à l'aide de fonctions du type Hammett est décrite. Est abordé aussi le problème des microconstantes. Enfin, la possibilité de la prédiction des valeurs des constantes est également discutée.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Jean-Louis BURGOT : Professeur honoraire des Universités - Membre de l'Académie de pharmacie
INTRODUCTION
Parmi les propriétés physico-chimiques des molécules, la constante d'acidité (Ka ou pKa) revêt une importance particulière. En effet, de très nombreuses espèces chimiques possèdent un caractère acido-basique. Cet article est consacré à sa détermination en milieu aqueux.
La constante de dissociation acide Ka , ou son alter ego la grandeur pKa , est une constante thermodynamique. Elle est donc définie en termes d'activités. Il en résulte un certain nombre de conséquences. C'est la raison pour laquelle nous consacrons une première partie à un bref rappel de thermodynamique des solutions. Dans la deuxième, nous donnons sa définition en milieu aqueux. Dès lors, il devient possible de cerner l'intérêt de sa détermination. Ce que nous faisons dans la troisième partie. Dans la quatrième, nous exposons une méthodologie générale très précieuse pour la détermination de constantes d'équilibre (entre autres constantes). Elle consiste à réaliser la simulation la plus exacte possible des résultats expérimentaux à l'aide d'un procédé de moindres carrés.
Nous étudions ensuite la détermination des pKa par différentes méthodes. Il convient de signaler qu'il existe souvent plusieurs variantes de chacune de ces méthodes. Nous faisons délibérément le choix de n'en évoquer que quelques unes. Il est fondé essentiellement sur la pertinence scientifique ou sur la simplicité d'utilisation. Nous détaillons particulièrement les méthodes potentiométrique et spectrophotométrique UV-visible qui sont les plus faciles et les moins onéreuses à mettre en œuvre. Ce sont d'ailleurs les plus utilisées. Nous insistons sur certains aspects méthodologiques les concernant. À l'occasion de l'étude de la méthode spectrophotométrique, nous décrivons la détermination des valeurs de pKa extrêmes à l'aide des fonctions de Hammett qui précisément fait appel à la spectrophotométrie. Cela fait l'objet des cinquième et sixième parties. Dans la septième partie, nous envisageons aussi la détermination par conductométrie qui historiquement a rendu de grands services en ce domaine.
La huitième partie est consacrée à diverses méthodes, finalement moins utilisées que les précédentes, à savoir celles basées sur des mesures de solubilité et celles impliquant l'utilisation d'appareils plus onéreux que les précédents tels que ceux de RMN, d'électrophorèse capillaire, de HPLC, de polarographie et de voltammétrie. Bien que ces dernières méthodes soient indubitablement d'avenir, nous nous bornons, étant donné leur utilisation onéreuse et moins courante, à en exposer que leur principe et leurs avantages en ce domaine.
La détermination des valeurs de pKa des constantes microscopiques pose un problème très intéressant. En effet, d'après le « corpus » même de la thermodynamique, elles ne peuvent être déterminées rigoureusement. Elles ne peuvent l'être qu'à partir d'hypothèses extrathermodynamiques. Ces considérations font l'objet de la neuvième partie. Enfin, cet article ne peut pas ignorer qu'il est possible de prévoir raisonnablement les valeurs de pKa d'une molécule, possibilité que nous évoquons finalement.
Dans cet article, nous utilisons indifféremment les expressions : constante d'acidité, constante de dissociation acide ou constante d'ionisation. Il n'y a pas d'inconvénient à le faire en milieu aqueux où l'on ne peut mettre en évidence séparément les phénomènes d'ionisation et de dissociation. Ce n'est pas le cas pour certains milieux non aqueux.
MOTS-CLÉS
constante d'acidité potentiométrie spectrophotmétrie UV-visible communications optiques imagerie infrarouge
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
5. Détermination des pKa par potentiométrie
La méthode potentiométrique, et plus précisément pH-métrique, est très probablement la plus utilisée pour la détermination des pKa . L'une des raisons de cet état de fait est qu'elle ne nécessite pas pour son utilisation une structure particulière du composé à étudier comme par exemple la présence d'un groupement absorbant dans l'UV-visible, celle d'un groupement électroactif, ou encore celle d'un type d'atome actif en RMN, etc. Nous faisons le choix de décrire l'application de la méthodologie générale déjà décrite ainsi qu'une approche très simplifiée et aussi très simple des valeurs de pKa .
5.1 Principe général : cas d'un monoacide du type HA, BH+
Le monoacide peut être de tous les types possibles, par exemple des types suivants : HA, BH+. Nous ne traitons essentiellement que le cas de HA. Le traitement des autres types d'acides est analogue à condition d'utiliser les équations algébriques adaptées aux conditions chimiques.
Considérons le pKa exprimé à partir de la relation (20) :
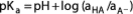
que nous écrivons maintenant sous la forme suivante pour alléger l'écriture :
(Dorénavant, les activités seront représentées entre parenthèses et les concentrations entre crochets).
Le principe de ce type de détermination découle de cette relation. On pratique le titrage d'une solution contenant une concentration connue de l'acide...
TEST DE VALIDATION ET CERTIFICATION CerT.I. :
Cet article vous permet de préparer une certification CerT.I.
Le test de validation des connaissances pour obtenir cette certification de Techniques de l’Ingénieur est disponible dans le module CerT.I.
de Techniques de l’Ingénieur ! Acheter le module
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Détermination des pKa par potentiométrie
BIBLIOGRAPHIE
-
(1) - LEWIS (G.N.) - Outlines of a new system of thermodynamic chemistry. - Proc. Am. Acad., 43, p. 259 (1907).
-
(2) - IUPAC - Quantities, units and symbols in physical chemistry. - 2nd edition, Blackwell Science Edit., London, p. 50 (1993).
-
(3) - GLASSTONE (S.) - Thermodynamics for chemists. - 11nd printing, D. Van Nostrand company Inc, Edit., Princeton, p. 350 (1960).
-
(4) - PITZER (K.S.) - Thermodynamics. - 3rd edition, McGraw-Hill International Editions, Edit., New York, p. 182 (1995).
-
(5) - BOCKRIS (J.O'M.), REDDY (A.K.N.) - Modern electrochemistry, tome 1 Ionics. - 2nd edition, Plenum Press, Edit., New York, p. 225 (1998).
-
(6) - HILL (T.L.) - An introduction to statistical thermodynamics. - Dover Publications Inc. Edit., New York, p. 32...
ANNEXES
Valeurs de pKa compilées par R. WIlliams http://www.fm.ehcc.kyoto-u.ac.jp/pKa_compilation_Williams_RipinEvans.pdf
HAUT DE PAGECet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
 QUIZ ET TEST DE VALIDATION PRÉSENTS DANS CET ARTICLE
QUIZ ET TEST DE VALIDATION PRÉSENTS DANS CET ARTICLE
1/ Quiz d'entraînement
Entraînez vous autant que vous le voulez avec les quiz d'entraînement.
2/ Test de validation
Lorsque vous êtes prêt, vous passez le test de validation. Vous avez deux passages possibles dans un laps de temps de 30 jours.
Entre les deux essais, vous pouvez consulter l’article et réutiliser les quiz d'entraînement pour progresser. L’attestation vous est délivrée pour un score minimum de 70 %.
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive











