Présentation
RÉSUMÉ
Les procédés d'hydratation des oléfines se sont fortement développés pour produire industriellement des alcools. Cet article décrit les caractéristiques thermodynamiques et cinétiques des réactions mise sen œuvre. Puis la mise en œuvre industrielle de ces réactions est présentée en détail pour obtenir du butanol-2, de l’éthanol et du propanol-2.
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleAuteur(s)
-
Bernard TORCK : Ingénieur de l’École des hautes études industrielles de Lille et de l’École nationale Òsupérieure du pétrole et des moteurs - Ingénieur-docteur de l’Université de Paris - Expert à la Direction stratégie-économie-programme de l’IFP (Institut français du pétrole)
INTRODUCTION
L’hydratation des oléfines (ou alcènes) est mise en œuvre industriellement pour obtenir des alcools par addition d’eau sur la double liaison des oléfines. Alors que les premières unités industrielles concernaient surtout la réaction inverse de déshydratation des alcools, obtenus par fermentation, en oléfines, l’installation de vapocraqueurs produisant des quantités importantes d’oléfines ayant 2 à 4 atomes de carbone a contribué à promouvoir progressivement la production d’alcools par hydratation.
Le présent article traite des aspects thermodynamiques et cinétiques des réactions d’hydratation des oléfines, des catalyseurs et des mécanismes réactionnels. Puis sont décrits les procédés industriels d’obtention du butanol-2, de l’éthanol et du propanol-2.
VERSIONS
- Version archivée 1 de sept. 1985 par Bernard TORCK
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
3. Réactions principale et secondaires
3.1 Réaction principale
L’hydratation des oléfines s’effectue par addition d’eau sur la double liaison, selon la réaction équilibrée :
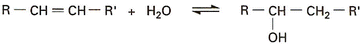
Cette réaction étant catalysée par les acides, l’addition du groupement OH s’effectue, selon la règle de Markovnikoff, sur le carbone le plus substitué et l’on n’obtient donc que les alcools tertiaires ou secondaires, excepté dans le cas de l’éthanol obtenu à partir d’éthylène.
Ainsi, l’isobutène donne l’alcool tert-butylique. Le mélange du butène-1 et des butènes-2 conduit au même alcool, l’alcool sec-butylique. Les deux méthyl-2-butènes-1 et -2 s’hydratent pour donner le même alcool, le méthyl-2-butanol-2.
Comme la réaction est équilibrée et exothéramique, la formation d’alcool n’est pas favorisée par addition directe d’eau sur la double liaison de l’oléfine, en présence de catalyseurs fonctionnant dans des conditions opératoires acceptables par l’industrie. Aussi, pendant longtemps, il s’est avéré préférable de synthétiser les alcools par hydratation indirecte en présence d’acide sulfurique.
HAUT DE PAGE3.2 Schéma réactionnel
-
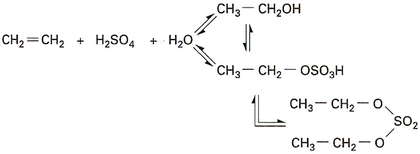
L’hydratation indirecte s’effectue par l’intermédiaire d’esters sulfuriques obtenus par absorption de l’oléfine dans une solution d’acide sulfurique, ces esters étant ensuite hydrolysés en alcools dans une seconde étape par dilution à l’eau, selon les réactions ci-après dans le cas de l’hydratation indirecte de l’éthylène en éthanol [20].
![]() ...
...
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Réactions principale et secondaires
BIBLIOGRAPHIE
-
(1) - * - + historique de la question
-
(2) - * - ★ étude théorique de la question
-
(3) - * - Δ comporte des résultats d’essais de laboratoire
-
(4) - * - △ comporte des résultats pratiques ou industriels
-
(5) - * - étude technologique de la question
-
(6) - * - description d’appareillage ou d’installations
-
(7) - Seclected values of properties of hydrocarbons and related compounds. - Thermodynamics Research Center, Hydrocarbon Project 1981 Texas – University Collège Station.
- ...
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(370 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive









 ...
...
