Présentation
Auteur(s)
-
Gilbert DANA : Ancien élève de l’École normale supérieure - Ancien professeur à l’université Pierre-et-Marie-Curie
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Comme toute méthode spectroscopique, la spectroscopie infrarouge met en jeu des échanges d’énergie entre une molécule et un rayonnement électromagnétique.
Dans l’infrarouge proche (12 500 à 4 000 cm−1) et moyen (4 000 à 650 cm−1), on observe des transitions entre les niveaux d’énergie vibrationnelle qui sont quantifiés.
Dans l’infrarouge lointain (jusqu’à 10 cm−1), on observe des transitions entre niveaux d’énergie rotationnelle également quantifiés.
En chimie organique, c’est l’infrarouge moyen qui est le plus souvent exploité mais la région entre 650 et 250 cm−1 rend de grands services en chimie de coordination.
DOI (Digital Object Identifier)
CET ARTICLE SE TROUVE ÉGALEMENT DANS :
Accueil > Ressources documentaires > Environnement - Sécurité > Métier : responsable risque chimique > Introduction aux constantes physico-chimiques > Constantes des spectres infrarouges > Application du modèle au cas des molécules polyatomiques
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
2. Application du modèle au cas des molécules polyatomiques
2.1 Dénombrement des vibrations fondamentales d’une molécule
Les différentes liaisons d’une molécule peuvent être traitées comme autant d’oscillateurs harmoniques, mais les expressions de type
qui négligent l’influence des groupes voisins ne sont pas très précises. Elles restent très utiles pour calculer les changements de fréquence associés à de petites modifications de structure (substitution isotopique ou autres).
Dans le cas d’une molécule non rectiligne de n atomes, il y a 3n degrés de liberté (3 coordonnées par atome) correspondant à 3n−6 mouvements de vibration (mouvements présentant une force de rappel dans la molécule : on écarte donc les trois translations et les trois rotations. Pour une molécule rectiligne, on ne peut écarter que deux rotations et il reste 3n−5 mouvements de vibration. Il existe donc généralement 3n−6 vibrations fondamentales, désignées par ν pour les élongations (vibrations de valence ou stretching) et par δ pour les déformations angulaires (bending), éventuellement par γ si ces déformations ont lieu hors du plan (gauchissement).
pour la molécule H2O, on trouve effectivement trois bandes d’absorption à 3 652, 3 756 et 1 596 cm−1 correspondant respectivement aux trois vibrations suivantes:
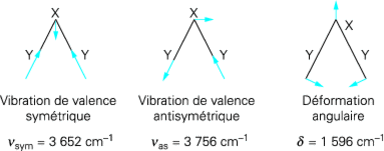
Dans la première vibration de valence, les élongations sont en phase ; dans la seconde, elles sont en opposition de phase. La flèche symbolisant le petit déplacement de l’atome central X rappelle simplement que le centre de gravité de la molécule doit rester immobile.
2.2 Règle de sélection en infrarouge
Une...
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Application du modèle au cas des molécules polyatomiques
BIBLIOGRAPHIE
-
(1) - GILLI (G.) et coll - * - J. Amer. chem. Soc. 116, p. 909 (1994).
-
(2) - KAYE (W.) - * - Spectrochimica Acta p. 257 (1954) ; p. 181 (1955).
-
(3) - COOPER (J.W.) - Spectroscopic techniques for organic chemists. - John Wiley and Sons, New York (1980).
-
(4) - RAO (C.N.R.) - Chemical applications of infrared spectroscopy. - Academic Press, New York et Londres (1963).
-
(5) - WOJTKOWIAK (B.), CHABANEL (M.) - Spectrochimie moléculaire. - Technique et documentation, Paris (1977).
-
(6) - PRETSCH (E.), CLERC (T.), SEIBL (J.), SIMON (W.) - Spectral data for structure determination of organic compounds. - Springer Verlag, Berlin Heidelberg (1997).
-
...
Cet article fait partie de l’offre
Caractérisation et propriétés de la matière
(115 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive