Comprendre comment interagissent les cellules souches à l’origine des cellules sanguines dans la moelle osseuse, c’est l’objectif de ce nouvel organe sur puce développé par une équipe du CEA et de l’Inserm.
Une nouvelle conception d’organe sur puce a été développée par une équipe du CEA et de l’Inserm. En reproduisant artificiellement le fonctionnement de la moelle osseuse, des chercheurs veulent mieux comprendre le fonctionnement des cellules souches hématopoïétiques – à l’origine de l’ensemble des cellules sanguines – dans leur micro-environnement : comment ces cellules souches interagissent avec les différentes cellules de leur voisinage, et comment cette communication complexe contrôle la biologie des cellules souches. En effet, il est maintenant acquis que des perturbations du micro-environnement de ces cellules au sein de la moelle osseuse peuvent être à l’origine de maladies du sang, telles que des leucémies ou différents déficits immunitaires.

Les premiers résultats ont été publiés dans l’édition de novembre de la revue The journal of Cell Biology. Nous avons échangé avec Stéphane Brunet, chercheur Inserm au CytoMorphoLab, pour comprendre en quoi cet organe sur puce permet une meilleure compréhension du fonctionnement de ces cellules souches et son utilité pour la recherche médicale.
Techniques de l’Ingénieur : Pourquoi avoir développé une « moelle osseuse sur puce » pour étudier les cellules souches ?
Stéphane Brunet : Le projet est d’étudier la biologie cellulaire des cellules souches hématopoïétiques humaines. Ces cellules souches sont cruciales car elles donnent naissance, en se différenciant, à l’ensemble des cellules sanguines (macrophages, globules rouges, plaquettes, etc.) et ce, pendant toute la vie. Elles sont d’ailleurs utilisées depuis des décennies en thérapie cellulaire pour soigner de nombreuses maladies du sang. Ces cellules résident dans la moelle osseuse. Leur état de quiescence, de prolifération ou leur engagement dans des voies de différenciation dépendent des multiples signaux émis par leurs micro-environnements, que l’on appelle aussi « niches ». Il y a, pour simplifier, deux niches : la niche vasculaire, proche du réseau d’artérioles de la moelle, et la niche endostéale qui jouxte la paroi osseuse. Les cellules souches dans chaque niche interagissent directement avec des cellules particulières. Elles vont recevoir des molécules spécifiques sécrétées par leurs cellules voisines. Enfin, elles sont en contact avec des substrats soit durs (la paroi osseuse) soit mous (les artérioles). La combinaison de tous ces signaux contrôle ainsi localement la biologie des cellules souches. Comment étudier à l’échelle cellulaire la communication des cellules souches avec des micro-environnements aussi complexes au sein de l’os ? Cette question est très compliquée !
Les développements récents des techniques de microscopie intravitrale permettent des approches in vivo. Cependant, ces travaux sont menés essentiellement chez la souris, et l’approche à l’échelle de la cellule reste ardue. Des approches de culture cellulaire classique sont aussi utilisées : on ensemence dans une boîte de culture des cellules d’intérêt sur lesquelles on dépose des cellules souches hématopoïétiques. Le problème, c’est que cette technique nous éloigne des conditions physiologiques réelles. Par exemple, les signaux émis diffusent dans le volume de culture, ce qui n’est pas très satisfaisant pour l’étude d’effets « locaux ». Cela fait donc une dizaine d’années que différents laboratoires essaient de développer des systèmes d’une complexité intermédiaire entre le in vivo et la boîte de co-culture. C’est là qu’intervient l’organe sur puce.
Pouvez-vous nous décrire votre système sur puce ?
Le principe est de reproduire les différentes niches physiologiques de la moelle osseuse dans un système miniaturisé unique, donc une puce, et en trois dimensions grâce à l’utilisation d’hydrogel. Un système d’alimentation par micro-canaux – c’est une puce « microfluidique » – permet de charger les cellules spécifiques des niches et les cellules souches dans des compartiments distincts mais qui communiquent entre eux. D’autres canaux assurent l’alimentation des cellules en milieu de culture. Un premier compartiment est ensemencé avec des cellules endothéliales qui vont s’organiser dans le gel en petits vaisseaux : ce compartiment mime la niche vasculaire. Un second compartiment est ensemencé avec des cellules appelées ostéoblastes pour mimer le compartiment endostéal. Entre les deux, un canal permet l’introduction des cellules souches qui vont pouvoir migrer dans le gel et entrer dans l’un ou l’autre des compartiments. Ainsi on peut suivre le comportement de la cellule souche spécifiquement dans chaque compartiment. Chaque niche fait 500 microns de large et quelques millimètres de long, pour une hauteur proche de 50 microns. La puce est en silicone et collée sur une lamelle en verre. Ceci nous permet de faire de l’imagerie à haute résolution sur des cellules vivantes, mais aussi de fixer chimiquement la puce pour analyser ensuite les niches par microscopie en fluorescence.

Quel est le comportement des cellules souches dans ces niches ?
Les cellules souches sont très mobiles dans le gel, mais elles peuvent venir au contact des cellules des vaisseaux ou des ostéoblastes : elles se fixent sur ces cellules, et vont se déformer et maintenir un ancrage par une structure qui ressemble à un long bec ou à un col de bouteille ! Leur architecture est totalement remaniée : elles sont « polarisées ». Cette polarisation avait déjà été observée in vivo, mais grâce à notre système, nous avons pu décortiquer les bases cellulaires et moléculaires de ces interactions polarisantes. La description de ce processus est importante d’un point de vue biologique : il va déterminer le mode de division de la cellule souche et son identité future. C’est aussi ce mode d’interaction très particulier qui pourrait être altéré dans le cas de transformation cancéreuse ! C’est l’hypothèse que nous sommes en train de tester actuellement…
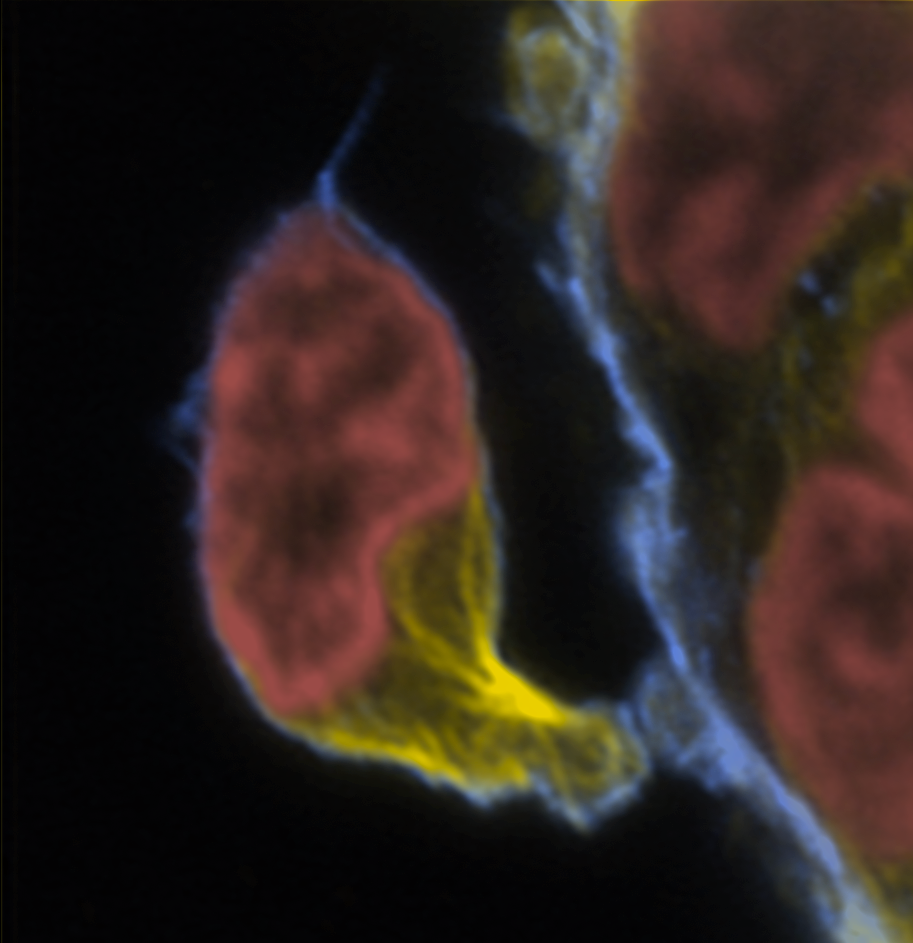
Quelle est la spécificité de votre système sur puce ?
C’est la topologie qui est vraiment nouvelle. Nous souhaitions vraiment avoir dans la même puce deux compartiments distincts et distants qui coexistent et miment les niches principales de la moelle osseuse, avec au milieu un système d’alimentation pour que les deux compartiments soient accessibles aux cellules souches. Je dirais que nous avons un système simple mais complet…
Par analogie avec les puces électroniques, il s’agit d’un système de culture cellulaire miniaturisé qui contient des circuits d’alimentation : des canaux pour faire rentrer des cellules dans les compartiments et des canaux d’alimentation en milieu de culture qui en plus peuvent être perfusés avec des solutions contenant des drogues par exemple pour modifier expérimentalement les niches. Tous ces circuits permettent la circulation de cellules ou de molécules, que l’on peut de plus récolter en sortie. À l’issue d’une période longue de culture, on peut par exemple récupérer les cellules pour les caractériser. En d’autres termes, la puce microfluidique permet de communiquer expérimentalement avec la moelle osseuse.
Nous avons aussi utilisé une technologie innovante : cette puce est conçue par photolithographie sans masque, une compétence que nous avons développée au CEA dans le cadre d’un partenariat avec la société Alvéole. Le principe est le suivant : une image du plan de la puce est projetée sur une résine photosensible. La résine ne polymérise par exposition aux UV que dans les zones du plan. Un moule plein de la puce est ainsi généré sur lequel on coule et polymérise du silicone liquide. En démoulant le silicone, on obtient en creux les canaux et les compartiments. Les extrémités des canaux sont ensuite perforées pour rendre accessibles les circuits d’alimentation. Le tout est collé par plasmatisation sur une lamelle… il n’y plus qu’à ensemencer les cellules dans leur hydrogel qui polymérisera dans les compartiments !
Avez-vous rencontré des difficultés dans la conception ?
Bien sûr ! En premier lieu, une des difficultés était de concevoir les plans d’une puce fonctionnelle qui réponde à toutes nos attentes. Un autre vrai challenge : arriver à induire l’auto-organisation des cellules endothéliales en réseau vasculaire. Une troisième difficulté s’est posée avec le compartiment endostéal, car les ostéoblastes sont des cellules extrêmement contractiles. Au début, lorsqu’elles étaient ensemencées dans le gel, elles le contractaient jusqu’à ce qu’il s’effondre, le compartiment ne tenait pas du tout ! Nous avons repensé ce compartiment et rajouté de nombreux petits piliers pour le maintenir. Ce qui nous donne une sorte de temple grec avec colonnes. Cette configuration nous permet du coup de reproduire une caractéristique physiologique de ce compartiment qui est très rigide, puisque osseux.
Quelle est l’utilité de ce genre de système ?
Ce système permet l’observation des cellules souches vivantes, de suivre leur migration, leurs interactions avec les autres types cellulaires des niches et l’effet de ces interactions sur leur devenir : comment se divisent-elles, vont-elles se différencier ? On peut également fixer chimiquement ces puces à un instant donné et étudier à l’échelle moléculaire les architectures de l’ensemble des cellules présentes. On peut enfin collecter les cellules en fin de culture et analyser l’effet de leur résidence dans l’un ou l’autre compartiment sur leur identité, leur fonctionnalité. Toutes ces questions de biologie cellulaire fondamentale peuvent être posées en contexte sain mais aussi en contexte pathologique : on sait que des altérations de la communication entre cellules souches et leur micro-environnement sont à l’origine de l’émergence de cellules cancéreuses, mais les mécanismes sont encore peu connus ; nous avons initié des recherches pour répondre à ces questions.
À plus long terme, on peut aussi penser que nous aurons la possibilité de modifier la composition de chaque compartiment pour contrôler, orienter le destin des cellules souches hématopoïétiques qui y résideront et donc produire des cellules « à façon ».
En bref, cet outil doit nous permettre de disséquer à l’échelle cellulaire, mais aussi de contrôler expérimentalement, la communication des cellules souches hématopoïétiques avec leurs micro-environnements. C’est un enjeu majeur dans le domaine de la biologie des cellules souches.
Peut-il également vous permettre de tester des médicaments ?
Oui. Grâce aux systèmes de canaux d’alimentation, mais aussi à la présence de canaux vasculaires, nous pouvons perfuser des molécules d’intérêt, drogues, médicaments, pour évaluer leur effet sur les cellules – cellules souches ou cellules leucémiques introduites dans la puce – et ce sur des durées de culture plus ou moins longues.
Le système est-il spécifique pour les cellules souches hématopoïétiques ?
Notre puce reproduit les micro-environnements de ces cellules souches particulières. Mais c’est un système transposable. À l’hôpital Saint-Louis par exemple, nos outils peuvent directement être utilisés pour étudier d’autres cellules sanguines dans ces environnements. D’autre part nous pouvons travailler sur des cellules souches saines mais aussi sur des cellules souches leucémiques, donc étudier les niches hématopoïétiques en contexte pathologique. Cet outil permet donc à la fois des travaux de recherche fondamentale et appliquée. Plus généralement, chaque cellule souche est conditionnée par son micro-environnement, chaque cellule souche possède une ou plusieurs niches spécifiques. En utilisant les techniques de micro-fabrication, on peut recréer les niches de n’importe quelle cellule d’intérêt.
Il peut donc vous permettre de réaliser des tests sans modèle animal ?
Effectivement, cette question est importante et a par exemple contribué à la récente explosion des systèmes appelés organoïdes. Dans ces systèmes, on se sert des propriétés d’auto-organisation des cellules pour former des micro-tissus multicellulaires en 3D et pour étudier ces cellules dans des conditions proches des conditions physiologiques, mais ex-vivo.
De la même manière, la puce microfluidique nous permet de réaliser des expériences, de poser un certain nombre de questions biologiques et de réaliser de nombreux tests tout en s’affranchissant de l’utilisation de modèles animaux. Ces systèmes alternatifs sont clairement appelés à se développer dans les années à venir !




















Réagissez à cet article
Vous avez déjà un compte ? Connectez-vous et retrouvez plus tard tous vos commentaires dans votre espace personnel.
Inscrivez-vous !
Vous n'avez pas encore de compte ?
CRÉER UN COMPTE