Des chercheurs ont quantifié et analysé finement le fonctionnement des protéines bactériennes favorisant la formation de glace et des protéines antigel des insectes. Ils arrivent désormais à prédire la température de nucléation de la glace en fonction de la quantité de ces protéines.
Certains insectes, poissons ou bactéries, ont développé des systèmes leur permettant de se protéger du gel ou au contraire d’utiliser la glace pour attaquer leurs ennemis. Ces systèmes s’appuient sur la production de protéines nucléant la glace (INP) ou de protéines antigel (AFP pour antifreeze protein).
On savait que les INP sont généralement volumineuses, qu’elles forment des agrégats dans la membrane cellulaire et qu’elles permettent d’initier la nucléation de la glace à des températures plus élevées alors que les protéines antigel des insectes (AFP) sont solubles et généralement petites. Cependant, on n’était pas capable de quantifier et comprendre finement ces processus. Une avancée importante a été faite en ce sens grâce aux travaux de chercheurs de l’Université de l’Utah parus dans le journal de l’American Chemical Society (ACS). Ces travaux permettent de prédire la température à laquelle une bactérie va initier la nucléation de la glace en fonction du nombre de protéines de nucléation dont elle dispose. Une donnée clé qui peut aider à mieux comprendre certains phénomènes météorologiques et certains processus au sein des nuages pour prévoir les précipitations. En effet, si aux hautes altitudes, ce sont principalement les suies et les poussières qui déclenchent la nucléation dans les nuages et éventuellement les précipitations, à basse altitude, à des températures plus chaudes, ce sont les bactéries qui jouent ce rôle.
La bactérie qui gèle les plantes
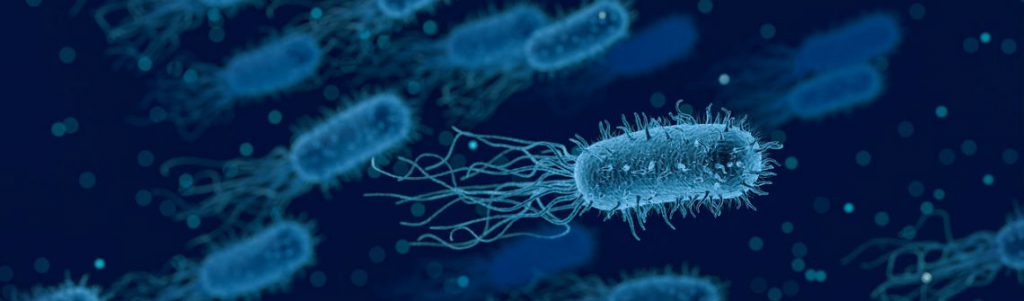
Pseudomonas syringae (Ps. Syringae) est une bactérie qui a la particularité de faire nucléer la glace pour induire des dommages chez ses hôtes. Pour cela elle utilise des protéines qui favorisent la formation de glace. Rappelons que l’eau pure ne se transforme pas forcément en glace spontanément à son point de fusion 0°C mais qu’en raison de phénomènes de surfusion, il est courant qu’elle ne change de phase qu’à des températures de l’ordre de -35°C à pression normale. Ce sont les impuretés qui font ordinairement geler la glace à son point de fusion 0°C.
Les impuretés naturellement contenues dans l’eau qui circule sur Terre sont un point d’appui sur lesquels le réseau cristallin de la glace va se former ; c’est le phénomène de nucléation. Ps. Syringae utilise cette propriété pour accélérer la formation de glace : elle produit des protéines qui se lient aux cristallites de glace naissants et qui favorisent le recrutement de nouvelles molécules d’eau dans le réseau cristallin. Ces protéines peuvent aussi s’agréger pour renforcer ce pouvoir de nucléation. Cette famille de protéines désignées sous le terme d’INP peut être si efficace qu’elle peut former de la glace à des températures de -2°C là où elle se formerait à -35°C. Une entreprise américaine (Snomax International) commercialise d’ailleurs un additif contenant Ps. Syringae pour booster des canons à neige.
Les protéines antigel, de leur côté, fonctionnent aussi en se liant à la glace. Mais, elles donnent à la glace une surface incurvée qui inhibe le recrutement de molécules d’eau supplémentaires et qui nécessite des températures encore plus froides pour que la glace se forme. Contrairement aux INP qui sont grandes, volumineuses et qui s’agrègent, les protéines antigel sont petites, solubles et solitaires.
Une taille critique
Les chercheurs ont déterminé que les protéines antigel et les INP se lient à la glace avec une force sensiblement égale. Grâce à un ensemble de simulations des interactions moléculaires entre les molécules d’eau et les protéines antigel (TmAFP de 2,5 nm de longueur) agissant sur la nucléation, ils ont pu déterminer que les protéines antigel ne protégeaient plus de la nucléation à une température de l’ordre de -33°C ± 1 ° C (ce qui correspond aux données expérimentales). Ils ont ensuite allongé ces protéines avec des boucles de liaison à la glace, ce qui a augmenté la température de nucléation. Après une certaine longueur, on atteint un plateau, mais on n’atteint jamais les performances de Ps. Syringae. Ces simulations ont servi de base pour le calcul d’autres simulations, cette fois avec les INP de Ps. Syringae. Les chercheurs ont ainsi prédit, en fonction de la longueur et du nombre de protéines dans les agrégats, qu’il faut atteindre au moins 34 INP pour que la température de nucléation remonte à -2°C. En outre, les chercheurs ont observé qu’il faut aussi que la distance entre les protéines dans les agrégats soit optimale pour atteindre une congélation maximale. Ce qui implique que les bactéries exercent d’une manière ou d’une autre un contrôle subtil entre la distance entre les INP dans leur membrane pour ajuster la température de nucléation.
Ces résultats ouvrent la voie à la conception de nouvelles protéines ou matériaux synthétiques qui initient la nucléation de la glace à une température donnée.




















Réagissez à cet article
Vous avez déjà un compte ? Connectez-vous et retrouvez plus tard tous vos commentaires dans votre espace personnel.
Inscrivez-vous !
Vous n'avez pas encore de compte ?
CRÉER UN COMPTE