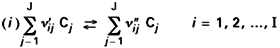Présentation
Auteur(s)
-
Guy-Marie CÔME : Professeur à l’Université Henri Poincaré — Nancy I - Directeur de Recherche au Département de Chimie Physique des Réactions, associé au Centre National de la Recherche Scientifique, à l’Institut Polytechnique de Lorraine (ENSIC) et à l’Université Henri-Poincaré — Nancy I
Lire cet article issu d'une ressource documentaire complète, actualisée et validée par des comités scientifiques.
Lire l’articleINTRODUCTION
Dans le fascicule Cinétique chimique générale- Cinétique expérimentale a été présentée une approche purement expérimentale de la modélisation cinétique.
La capacité prédictive de cette méthodologie est toutefois réduite et les aptitudes à l’extrapolation et à la transposition sont moins fortes que celles de modèles fondés sur les théories de la cinétique chimique.
Le présent fascicule Cinétique chimique générale- Cinétique expérimentale décrit l’approche mécanistique de la modélisation cinétique.
Après un rappel des principales formules de thermodynamique nécessaires pour aborder la théorie de l’état de transition, celle-ci est appliquée aux réactions élémentaires qui se déroulent en phase gazeuse et en phase liquide, ainsi qu’aux réactions élémentaires en catalyse hétérogène. Les principales corrélations entre grandeurs cinétiques de réactions élémentaires et grandeurs thermodynamiques des réactions ou paramètres structuraux des réactifs sont mentionnées.
Les méthodes d’obtention d’un mécanisme réactionnel, c’est-à-dire la façon dont on décompose une réaction globale en un ensemble de réactions élémentaires, sont alors décrites. On explicite ensuite sur des exemples la technique de calcul quasi stationnaire de lois cinétiques à partir de mécanismes réactionnels. C’est par généralisation des lois théoriques ainsi obtenues que les lois cinétiques empiriques proposées dans le fascicule Cinétique chimique générale- Cinétique expérimentale ont été établies.
Lorsque les connaissances cinétiques expérimentales et théoriques sur les réactions élémentaires sont importantes, ce qui est le cas pour les réactions en phase gazeuse, il devient nécessaire de recourir à l’ordinateur pour créer les modèles réactionnels et pour les simuler. La cinétique informatique a ainsi acquis droit de cité dans des domaines aussi variés que la combustion dans les moteurs, la conception ou l’optimisation de procédés industriels, la chimie troposphérique et stratosphérique, la déposition de solides à partir de gaz.
VERSIONS
- Version archivée 1 de déc. 1980 par Guy-Marie CÔME, Michel NICLAUSE
DOI (Digital Object Identifier)
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(369 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Présentation
1. Thermodynamique chimique
La thermodynamique chimique a quatre applications principales en cinétique.
-
Elle fournit les expressions des potentiels chimiques et des constantes d’équilibres, ce qui permet de calculer la composition à l’équilibre, soit en minimisant l’enthalpie libre totale du mélange réactionnel, soit en appliquant à chaque réaction la loi d’action des masses. On peut ainsi déterminer l’influence des conditions opératoires (température, pression, dilution) sur la composition à l’équilibre, ainsi que les conditions optimales de fonctionnement d’un réacteur où l’on met en œuvre une réaction équilibrée.
-
Elle permet de calculer la chaleur dégagée ou absorbée par la réaction et donc d’effectuer le bilan énergétique d’un réacteur.
-
Le calcul de la constante de vitesse k" d’une réaction élémentaire se déroulant de droite à gauche (sens inverse) peut se faire à l’aide de la relation suivante, qui est une conséquence du principe de l’équilibre détaillé :
k" = k ’ / Kcavec :
- k’ :
- constante de vitesse de la réaction dans le sens direct, de gauche à droite
- Kc :
- constante d’équilibre en concentrations de cette même réaction.
-
La théorie du complexe activé, qui est la théorie centrale de la cinétique, repose sur l’hypothèse d’un quasi-équilibre entre les réactifs et l’état de transition. La vitesse d’une réaction élémentaire s’exprime donc en fonction de la constante de cet équilibre. On peut utiliser pour cette constante les expressions établies à l’aide de la thermodynamique classique ou à l’aide de la mécanique statistique.
Nous présenterons les principales formules thermodynamiques pour le système suivant de réactions :
![]()
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(369 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive
Thermodynamique chimique
BIBLIOGRAPHIE
-
(1) - ALBERTY (R.A.) - Physical Chemistry. - 7e éd., Wiley (1987).
-
(2) - BAMFORD (C. H.), TIPPER (C. F. H.), COMPTON (R. G.) - Comprehensive chemical kinetics. - Elsevier, 33 volumes parus, (1994).
-
(3) - BARIN (I.) - Thermochemical data of pure substances. Partie I (Ag-Kr), Partie II (La-Zr) - VCH (1993).
-
(4) - BENSON (S. W.) - Thermochemical kinetics. - 2e édition, Wiley (1976).
-
(5) - BLOCH-MICHEL (V.) - Logiciel d’estimation de paramètres cinétiques de processus élémentaires en phase gazeuse. - Thèse, Nancy (1995).
-
(6) - BOUDART (M.) - Kinetics of chemical processes. - Prentice Hall (1968).
-
...
Cet article fait partie de l’offre
Opérations unitaires. Génie de la réaction chimique
(369 articles en ce moment)
Cette offre vous donne accès à :
Une base complète d’articles
Actualisée et enrichie d’articles validés par nos comités scientifiques
Des services
Un ensemble d'outils exclusifs en complément des ressources
Des modules pratiques
Opérationnels et didactiques, pour garantir l'acquisition des compétences transverses
Doc & Quiz
Des articles interactifs avec des quiz, pour une lecture constructive